泽璟制药正在开展《ZG006在晚期小细胞肺癌或神经内分泌癌患者中的耐受性、安全性、有效性和药代动力学的剂量递增和多队列扩展的I/II期临床研究》(方案编号:ZG006-001)。初步数据显示,注射用ZG006在I期剂量递增及扩展研究中,呈现出良好的耐受性、安全性及优异的抗肿瘤疗效。特别是晚期小细胞肺癌患者接受ZG006 10 mg及以上剂量治疗后的疗效显著,基于截至2024年8月8日的数据结果显示客观缓解率(ORR)达到66.7%,疾病控制率(DCR)达到88.9%。
详细研究方案和研究数据即将在2024年欧洲肿瘤内科学会(ESMO)和第27届中国临床肿瘤学大会暨2024年CSCO学术年会公布。
关于ZG006临床数据及进展
截至2024年8月8日,《ZG006在晚期小细胞肺癌或神经内分泌癌患者中的耐受性、安全性、有效性和药代动力学的剂量递增和多队列扩展的I/II期临床研究》(方案编号:ZG006-001)在晚期小细胞肺癌或神经内分泌癌患者中I期剂量递增阶段已完成入组。已经完成的爬坡剂量组分别为0.1、0.3、1、3、10、30、60 mg组,可评估24例受试者,其中大多数受试者(17/24)既往曾接受过至少两线抗肿瘤药物系统治疗。
有效性方面,在21例疗效可评估的小细胞肺癌(SCLC)受试者中,7例获得部分缓解(PR),5例疾病稳定(SD)且其中4例为缩小的SD。在接受ZG006 10 mg及更高剂量的9例SCLC受试者中(10 mg组4例、30 mg组2例、60 mg组3例),有6例PR,其中10 mg组3例、30 mg组1例、60 mg组2例,ORR为66.7%;并有2例为肿瘤缩小的SD,DCR达88.9%。
安全性方面,24例受试者中,绝大多数治疗相关不良事件(TRAEs)的严重程度为1级或2级。最常见的TRAEs为发热、贫血和细胞因子释放综合征(CRS,3级CRS 1例)。未观察到剂量限制性毒性(DLTs)和免疫效应细胞相关神经毒性综合征(ICANS),也未发生导致治疗终止或死亡的TRAE。
综上,ZG006呈现出良好的耐受性、安全性及优异的抗肿瘤疗效,其中接受10 mg及以上剂量治疗的经多线治疗失败的晚期小细胞肺癌患者中的疗效尤为显著。目前ZG006两项II期临床扩展研究已启动,正在分别招募小细胞肺癌和神经内分泌癌患者,以进一步评估 ZG006的疗效和安全性。
关于注射用ZG006
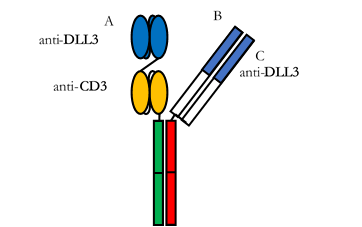
注射用ZG006结构图
注射用ZG006是公司及子公司Gensun Biopharma Inc.通过其双/多特异性抗体研发平台开发的一个三特异性抗体药物,同时获得美国FDA和中国NMPA临床试验许可,已被美国FDA授予孤儿药资格认定(Orphan-drug Designation)。经查询,ZG006是全球第一个针对DLL3表达肿瘤的三特异性抗体(CD3×DLL3×DLL3),是全球同类首创(First-in-Class)分子形式,具有成为同类最佳(Best-in-Class)分子的潜力。
ZG006是一种针对CD3及两个不同DLL3表位的三特异性抗体。ZG006的抗DLL3端与肿瘤细胞表面不同DLL3表位相结合,抗CD3端结合T细胞。ZG006衔接肿瘤细胞和T细胞,将T细胞拉近肿瘤细胞,从而利用T细胞特异性杀伤肿瘤细胞。临床前研究结果显示,ZG006在小鼠肿瘤模型上具有显著的肿瘤抑制作用,可以导致显著比例的小鼠肿瘤完全消退,说明ZG006具有强效的肿瘤杀伤作用。ZG006在非人灵长类动物中显示出毒副作用低等良好的安全性特征。







